近日,哈尔滨工业大学生命科学中心黄志伟课题组与美国斯坦福大学赵华(Wah Chiu)教授课题组合作在《美国科学院院报》(PNAS)上发表了题为《冷冻电镜技术揭示AcrF9,AcrF8和AcrF6对I-F CRISPR–Cas复合物的抑制机制》(Inhibition mechanisms ofAcrF9, AcrF8, and AcrF6 against type I-F CRISPR–Cascomplex revealed by cryo-EM )的研究文章。该研究使用冷冻电镜首次解析了三个Acr蛋白(AcrF9,AcrF8和AcrF6)抑制Csy复合物的结构,其分辨率分别为2.57Å,3.42Å和3.15Å。
原核生物和病毒之间的共进化已经持续了数百万年。原核生物利用由CRISPR和CRISPR相关(Cas)基因组成的适应性免疫系统来对抗病毒。细菌I-F型CRISPR-Cas通过crRNA指导的Csy复合物来识别外源DNA并募集核酸酶-解旋酶蛋白(即Cas2/3)降解病毒DNA。Csy复合物由四种Cas蛋白(Cas5f-8f)和一个60 nt的crRNA组成,即Cas5f16f17f68f1:crRNA1。病毒进化出多种anti-CRISPR(Acr)蛋白来识别并抑制CRISPR-Cas系统的功能,其中AcrF9、AcrF8和AcrF6抑制csy复合物的作用机制并不清楚。
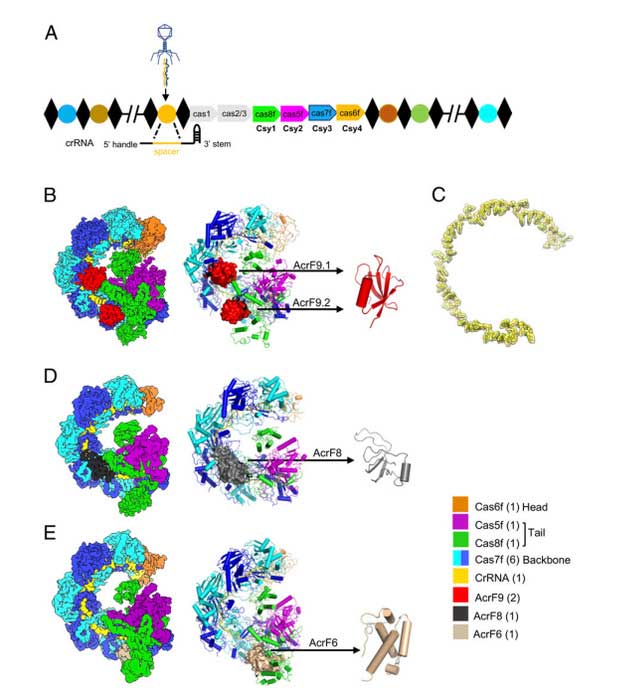
课题组通过解析三种复合物结构发现具有68个氨基酸残基的AcrF9由一对反平行β-折叠组成,两个分子AcrF9结合一个分子Csy复合物,多个氢键和疏水性相互作用介导了它们的互作。Cas7f亚基的富含赖氨酸的区域(K76,K78,K84和K256)对于Csy复合物的DNA结合至关重要,并且结构上也发现它也与AcrF9广泛相互作用,推测AcrF9可能竞争性结合Csy复合物的DNA结合位点。事实上,AcrF9突变体(Q38A和F40A)不再对Csy复合物的活性产生抑制作用,底物DNA被迅速降解,所以AcrF9通过竞争性结合DNA结合位点发挥其anti-CRISPR功能。此外结构发现AcrF9还与Cas8f亚基有互作,并导致整体构象的变化,Cas8f的环区域移动到闭合位置,从而将复合物与AcrF9的结合锁定;通过相似的结构生物学以及体外活性检测发现AcrF8结合Csy螺旋骨架抑制识别DNA底物。与前两者不同,AcrF6在Cas7.6f和Cas8f之间的交界处结合从而抑制DNA双链解旋。
斯坦福大学生物工程系( Department of bioengineering)张凯铭、李珊珊和我校生命学院王硕、朱玉威为本文共同第一作者, 赵华(Wah Chiu)教授和黄志伟教授为本论文共同通讯作者。(哈工大新闻网)
标签: 哈尔滨工业大学